¿Qué es IEC 62304?
IEC 62304 es una norma internacional armonizada que proporciona orientación al fabricante sobre la planificación, el desarrollo y las actividades de vigilancia posteriores a la comercialización de software de dispositivos médicos para garantizar que las empresas cumplan con los requisitos de las agencias reguladoras internacionales.
ISO/CEI
La velocidad de evolución del software y las aplicaciones en este período ha encontrado barreras para seguir este estándar, lo que ha retrasado la publicación de la versión 2 del estándar. Hoy se encuentra en discusión la tercera propuesta de esta versión del estándar, que propone un proceso de ciclo de vida del software que engloba el software guiado por la actual IEC 62304 y permite la adherencia de estas nuevas soluciones de software a los requisitos del estándar. Pero eso es tema para otro post. En esta publicación demostraré los puntos principales del estándar actual.
Campo de aplicación
La norma IEC 62304 se aplica al desarrollo y mantenimiento de software de equipos médicos cuando el software es en sí mismo un dispositivo médico o cuando el software es una parte integrada o integrada del equipo médico.
Esta norma no cubre la validación de la versión final del equipo médico.
El cumplimiento se determina inspeccionando todos los documentos estándar requeridos, incluido el archivo de gestión de riesgos, y evaluando los procesos, actividades y tareas requeridas para la clase de seguridad del software.
Calificación de seguridad del software
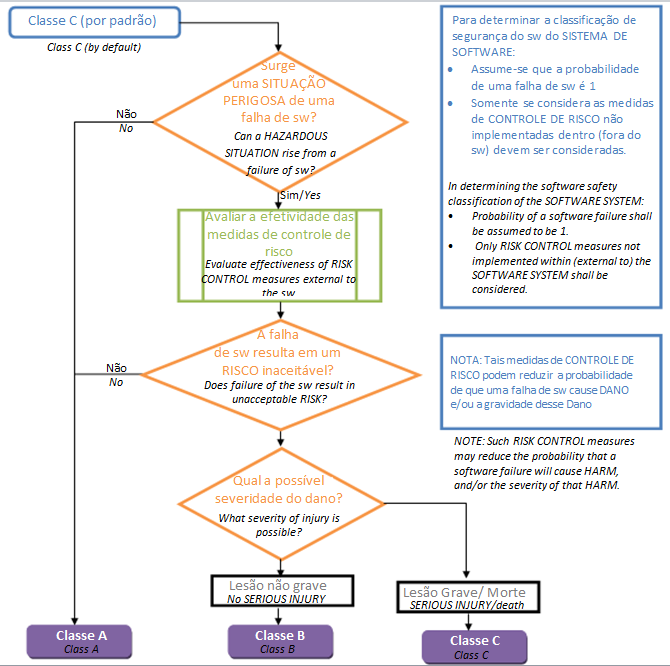
IEC 62304 identifica tres clases de seguridad para el software de dispositivos médicos:
Clase A: No es posible que se produzcan lesiones ni daños a la salud.
Clase B: las lesiones son posibles pero no graves.
Clase C: Posibilidad de muerte o lesiones graves.
Esta clasificación ayuda al fabricante a identificar los procesos relacionados con la seguridad necesarios a lo largo del ciclo de vida del software del dispositivo médico. Los requisitos aplicables son específicos para el desarrollo y codificación, lanzamiento y mantenimiento de software de dispositivos médicos. Están codificados en los componentes de IEC 62304.
Composición de IEC 62304
IEC 62304 para el desarrollo de software de dispositivos médicos describe los componentes en cinco cláusulas, numeradas del 5 al 9.
Cláusula 5: describe el proceso de desarrollo de software, desde la planificación hasta el lanzamiento.
Cláusula 6: describe el mantenimiento necesario del software publicado.
Cláusula 7: Especifica la gestión de riesgos necesaria desde la evaluación de fallas hasta la identificación de riesgos potenciales y la implementación de recursos para evitarlos.
Cláusula 8: Establece los requisitos de gestión de la configuración sobre cómo gestionar el entorno de desarrollo.
Cláusula 9: Explica los procesos de resolución de problemas en relación con el seguimiento y la evaluación para resolver los problemas a medida que surgen.
Lista de verificación según IEC 62304: 2006 Amd1: 2015
Espero que les haya gustado. Incluya los comentarios si desea profundizar en este tema o sugerir un tema que le gustaría ver presentado para discusión en las publicaciones.
Pregunta en los comentarios por el checklist de esta norma, deja tu nombre y e-mail te lo enviaremos sin cargo.
Hasta el próximo post




