
- => Defina su proceso de gestión de riesgos
- => Establecer reglas y responsabilidades de gestión
- => Documentar el plan de gestión de riesgos
- => Establecer un archivo de gestión de riesgos en vivo

- => Comprenda y defina el alcance de su dispositivo y documente el uso previsto

- => Identifique las posibles fuentes de daño asociadas con su producto. Esto se conoce como peligro

- => Estime el riesgo de cada situación peligrosa.

- => El riesgo es la combinación de la gravedad del daño potencial y la probabilidad de que ocurra el daño

- => ¿Están los riesgos a un nivel aceptable?
- => ¿Es necesaria la reducción de riesgos?
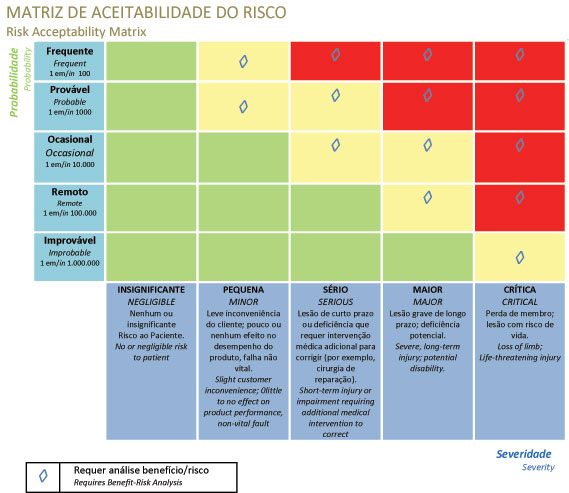

- => Utilice el control de riesgos para reducir el riesgo a niveles aceptables.
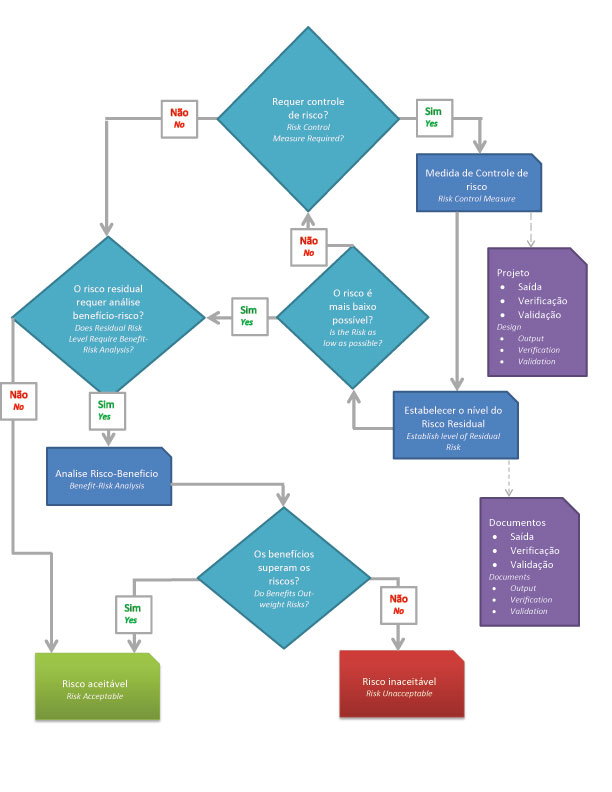

- => Evaluar el riesgo del producto en su totalidad.
- => ¿Es aceptable el nivel de riesgo?
- => ¿El beneficio supera los riesgos potenciales?

- => Realice un análisis de gestión de riesgos y prepare un informe de gestión de riesgos antes de enviar su dispositivo a producción comercial.

- => Auditorías internas, acciones preventivas y correctivas, cumplimiento, retroalimentación de los clientes, incumplimiento material, todas las fuentes en el proceso de gestión de riesgos.
- => La gestión de riesgos es un proceso para todo el ciclo de vida del producto.
En la próxima publicación, escribiré sobre consejos prácticos para una buena reunión de análisis de riesgos.Deja tu comentario y hasta el próximo post.





